ABLACE PULZNÍM POLEM IN VITRO
Cíl
Ablace pulzním polem (PFA) je nový typ ablační terapie používaný ke katetrizační léčbě fibrilace síní. Krátké vysokonapěťové elektrické pulzy (řádově μs) tvoří póry v buněčné membráně kardiomyocytů propustné pro Ca2+. Vtok Ca2+ je příčinou buněčné smrti. Pro rychlost PFA jsou nyní vyvíjeny generátory elektrických pulzů o různých charakteristikách, jejichž tkáňová efektivita se dle intenzity podané energie, délky a frekvence pulsů může lišit. Jelikož část mechanismu PFA spočívá v indukci apoptózy, může být dosaženo buněčné smrti ne bezprostředně po ablaci, ale s časovým posunem. Cílem studie bylo zjistit 1) efektivitu indukce buněčné smrti u HL-1 kardiomyocytů na základě různých intenzit elektrického pole PFA a 2) čas dosažení maxima efektivity.
Soubor a Metodika
Ke studiu byla použita nádorová linie HL-1 kardiomyocytů. Pro in vitro PFA byl použit komerční generátor elektrických pulzů TONAPULSE dodávaný s elektrodovou deskou (TONAGENA, ČR). Kardiomycyty byly vystaveny 2 μs bipolárním pulzům s pauzami 5 μs o celkem 216 pulzech. Této sérii pulzů byly buňky exponovány celkem 20x. Intenzita elektrického pole byla: 250 V/cm, 500 V/cm, 750 V/cm, 1000 V/cm, 1250 V/cm a 1500 V/cm. Buněčná smrt byla pozorována 1 h a 24 h po PFA pomocí fluorescenční barvy propidium iodidu.
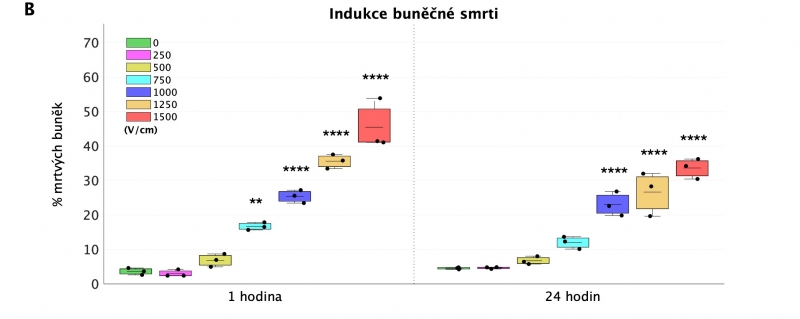
Výsledky
Po 1 h byla buněčná smrt efektivně indukována od 750 V/cm a výše (viz. obr. 1 – plocha léze a obr. 2 – grafické znázornění). Nejefektivněji byla indukována buněčná smrt při elektrickém poli 1500 V/cm – u 99,6 +/- 10 % kardiomyocytů. Po 24 hodinách byla buněčná smrt efektivně indukována opět od 750 V/cm avšak v nižších poměrech (viz. obr. 2).
Závěr
PFA je efektivní při energii nad 750 V/cm po 1 h a po 24 h. Po 24 h poměr buněčné smrti poklesl. Jev může být způsoben například reparací poškozených buněk nebo proliferujících kardiomyocytů vzhledem k jejich nádorovému charakteru.